Primer postulado
Los electrones describen órbitas circulares en torno al núcleo del átomo sin irradiar energía.
La causa de que el electrón no irradie energía en su órbita es, de momento, un postulado, ya que según la electrodinámica clásica una carga con un movimiento acelerado debe emitir energía en forma de radiación.
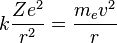
Segundo postulado
No toda órbita para electrón está permitida, tan solo se puede encontrar en órbitas cuyo radio cumpla que el momento angular,  , del electrón sea un múltiplo entero de
, del electrón sea un múltiplo entero de 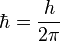 Esta condición matemáticamente se escribe:
Esta condición matemáticamente se escribe:
Tercer postulado
El electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra. En dicho cambio emite o absorbe un fotón cuya energía es la diferencia de energía entre ambos niveles. Este fotón, según la ley de Planck tiene una energía:

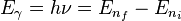

No hay comentarios:
Publicar un comentario